Żywienie w zaburzeniach osi mózgowo-jelitowej.
Na początek warto przytoczyć wyniki badania opublikowanego 2 lata temu, w którym porównano dwie grupy osób: jedną z lękami i depresją oraz drugą bez tych objawów. Okazało się, że ci pierwsi mieli znacznie podniesione wartości markerów tzw. nieszczelnego jelita w stolcu, czyli zonuliny oraz iFABP2. Wykazano również, że te osoby miały we krwi znacząco wyższą zawartość lipopolisacharydu (LPS) – uznanego markera endotoksemii. Osoby z lękami i/lub depresją miały też znacznie więcej bakterii Gram-ujemnych w jelicie. Przerost bakterii Gram-ujemnych wpływał negatywnie na szczelność bariery jelitowej, prowokując zjawisko jej przesiąkania i translokację prozapalnego LPS do krwiobiegu. LPS po dostaniu się do krwi pokonywał barierę krew-mózg i przechodził do mózgu, gdzie uruchamiał wiele reakcji skutkujących nasileniem lęku1.
Czym jest mikrobiota jelitowa?
Mikrobiota jelitowa jest zbiorem mikroorganizmów zamieszkujących przewód pokarmowy, składającym się z ogromnej gamy gatunków drobnoustrojów wchodzących w interakcje z organizmem gospodarza2. W jelitach namnażają się i funkcjonują nie tylko bakterie jelitowe, ale także archeowce (m.in. Methanobacterium, Woesearchaeota, Desulfurococcales, Sulfolobales, Thermoproteales, Nitrososphaerales, Halobacteriale)3, grzyby (Saccharomyces, Penicillium, Kazachstania, Candida)4 i wirusy (w tym bakteriofagi)5. Te mikroorganizmy wnoszą do metabolomu gospodarza wiele unikatowych możliwości, dodając do puli 23 tysięcy genów gospodarza około 8 milionów genów obcych gatunkowo6! Ten dodatkowy zbór genów (zwany „metagenomem”) ma duży wpływ na poszerzenie możliwości metabolicznych gospodarza, odgrywając ważną rolę w zdrowiu i chorobie. Z drugiej strony, to właśnie gospodarz podtrzymuje dobrostan mikroorganizmów poprzez odpowiednią dietę, aktywność fizyczną, stosowanie (lub nie) farmakoterapii. Od tych czynników zależy także funkcjonowanie połączenia między jelitami a mózgiem, zwanego osią mózgowo-jelitową, a prawidłowo funkcjonująca oś mózgowo-jelitowa wydaje się kluczowym czynnikiem zdrowia psychicznego.
Czym jest oś mózgowo-jelitowa?
To pojęcie oznacza fizyczne i biochemiczne połączenie neuronów jelitowych i centralnego układu nerwowego (CUN)7. Funkcjonalnie oś mózgowo-jelitowa zbudowana jest z neuronów nerwu błędnego i korzenia grzbietowego oraz nerwów układu nerwowego związanego z jelitami (enteralnego układu nerwowego). Te neurony w sposób bezpośredni łączą centralny układ nerwowy człowieka z przewodem pokarmowym7. Oś mózgowo-jelitowa stanowi także połączenie bardziej dyskretne – rozgrywane za pomocą hormonów, cytokin, związków immunokompetentnych i neuroaktywnych wydzielanych przez mikroorganizmy jelitowe, a wpływających na funkcje kluczowych obszarów mózgowia7.
Czy mamy jakieś dowody na to, że bakterie jelitowe mogą brać udział w stymulacji zaburzeń psychicznych?
Tak. Takie zaburzenia zostały już dobrze opisane dla chorób zapalnych jelita (IBD): choroby Leśniowskiego-Crohna (CD) oraz wrzodziejącego zapalenia jelita (UC), czyli u osób z ewidentnym zaburzeniem mikrobiomu jelitowego8. Szacuje się, że stany lękowe i depresja mogą pojawić się u 39% do 50% chorych z IBD, a ryzyko pojawienia się tych zaburzeń u chorych z CD czy UC wzrasta sześciokrotnie9, 10. Przeprowadzona analiza mikrobiomu u pacjentów z IBD wykazała szereg nieprawidłowości, takich jak wzrost względnej liczebności gatunków prozapalnych, zmniejszenie liczby przeciwzapalnych gatunków bakterii, takich jak Faecalibacterium prausnitzii, oraz zmniejszenie ogólnej różnorodności bakterii w porównaniu z osobami zdrowymi11.
Elementem łączącym mikrobiotę z funkcjonowaniem osi mózgowo-jelitowej są produkty mikroorganizmów: neuroprzekaźniki (takie jak: kwas γ-aminomasłowy, dopamina, noradrenalina, serotonina), krótkołańcuchowe kwasy tłuszczowe, aminy, enzymy, białka regulatorowe. Ich nasilona synteza lub ich niedobory (a także niedobór substancji niezbędnych do ich syntezy przez bakterie, np. witamin czy minerałów) mogą oznaczać pogorszenie funkcji osi mózgowo-jelitowej12.
Bakteriami „pogarszającymi” funkcjonowanie osi mózgowo-jelitowej poprzez syntezę metabolitów – przekraczających barierę krew-mózg, stymulujących stan zapalny, uszkodzenie aksonów czy demielinizację neuronów – są bakterie z klas Bacilli, Clostridia, Enterobacteria, Actenobacteria, Peptococci, Staphylococci, Streptococci oraz niektóre gatunki drożdży13. Te mikroorganizmy są powiązane z patogenezą chorób neurodegeneracyjnych (choroba Parkinsona, stwardnienie rozsiane czy choroba Alzheimera). Funkcję układu nerwowego poprawiają bakterie z gatunków Lacobacillus (L. rhamnosus, L. acidophilus, L. plantarum itp.), Bifidobacterium (B. bifidum), Enterococci, Propionobacteria i Peptostreptococci13.
Warto przyjrzeć się temu, które produkty i związki chemiczne dostarczane przez mikroorganizmy mogą zmienić funkcjonowanie mózgu.
Tryptofan (TRP)
Jest aminokwasem niezbędnym (ezgogennym), częściowo pozyskiwanym z pożywienia (bogate w TRP są orzechy, nasiona, tofu, ser, czerwone mięso, kurczak, indyk, ryby, owies, fasola, soczewica i jajka), a częściowo produkowanym dla nas przez bakterie jelitowe w okrężnicy2. Synteza tryptofanu przez bakterie (m.in. Clostridium bolteae, Clostridium hathewayi, Lactobacillus plantarum, Lactococcus lactis, Streptococcus thermophilus), nawet u człowieka z prawidłowym mikrobiomem, nie jest w stanie pokryć zapotrzebowania organizmu gospodarza na ten aminokwas (szacowane zapotrzebowanie dietetyczne to 3,5 mg/kg dziennie)2.
Dlaczego TRP jest kluczowym składnikiem diety, niezbędnym do prawidłowego funkcjonowania osi mózgowo-jelitowej? Dzieje się tak dlatego, że TRP może wejść na trzy różne ścieżki metaboliczne i w ten sposób pozytywnie lub negatywnie wpływać na samopoczucie psychiczne. Są to:
- szlak prowadzący do syntezy kinureniny,
- szlak prowadzący do syntezy serotoniny,
- szlak prowadzący do syntezy indolu.
Szlak kinureniny (KYN) jest głównym szlakiem metabolicznym, który obejmuje prawie 95% wolnego tryptofanu. Zachodzi w wątrobie oraz poza nią w komórkach układu nerwowego: neuronach, astrocytach, komórkach mikrogleju, komórkach układu odpornościowego (makrofagach)2. Enzymami biorącymi udział w syntezie KYN są: dioksygenaza 2,3 tryptofanowa (TDO, charakterystyczna dla przemian wątrobowych) oraz dioksygenaza 2,3 indolaminy (IDO, charakterystyczna dla tkanek pozawątrobowych). Aktywność TDO jest regulowana przez glikokortykosteroidy, metabolity TRP, kofaktory przemian hemu oraz NADPH14. Aktywność IDO jest regulowana przez czynniki zapalne (IFNγ, TNF-alfa, IL1B, IL 17). Oba enzymy są regulowane przez stres (kortyzol)14.
Obydwa enzymy przemian TRP są aktywowane pod wpływem stresu czy procesu zapalnego. W ten sposób indukowane przez bakterie jelitowe zapalenie może ograniczać dostępność tryptofanu do syntezy serotoniny, kierując TRP do przemian na ścieżce szlaku kinureniny. W mózgu KYN przekształcana jest do związku o działaniu wybitnie neurotoksycznym – kwasu chinolinowego (QUIN) lub do produktu neuroprotekcyjnego – kwasu kynurenowego (KYNA)15. KYNA ma działanie antyoksydacyjne, a także zmniejsza toksyczne działanie glutaminianu (poprzez działanie antagonistyczne w stosunku do receptorów dla glutaminianu – NMDA i AMPA, oraz receptorów cholinergicznych (nAChR) pośredniczących w presynaptycznym uwalnianiu glutaminianu15.
Neurotoksyczny kwas chinolinowy (QUIN) jest u osób zdrowych syntetyzowany (w mózgu i płynie mózgowo-rdzeniowym) w bardzo małych ilościach. Niestety w stanach patologicznych – np. przy zapalnej aktywacji osi mózgowo-jelitowej, zwiększonym wyrzucie wolnych rodników tlenowych i wolnych rodników azotowych – jego zawartość w mózgu zwiększa się i prowadzi do niszczenia neuronów GABA-ergicznych/cholinergicznych2, 16.
Szlak prowadzący do syntezy serotoniny
Tylko 1–2% uwalnianego w jelitach tryptofanu przekształcane jest w warstwie śluzowej nabłonka jelitowego do serotoniny17! A tymczasem serotonina jest związana z regulacją funkcji mózgu, takich jak kreowanie nastroju czy apetytu. Serotonina bierze udział w regulacji pracy układu pokarmowego, krwionośnego czy w syntezie melatoniny niezbędnej do zasypiania18. W syntezę serotoniny zaangażowane są dwa enzymy: hydroksylaza tryptofanowa (TPH) przekształcająca tryptofan do 5-hydroksytryptofanu (5-HTP) i dekarboksylaza aromatycznych L-aminokwasów (AADC) przekształcająca 5-HTP do serotoniny. Ten pierwszy enzym (TPH) jest wrażliwy na wiele czynników – jego aktywność jest zaburzona w warunkach hiperinsulinemii, hiperkortyzolemii (stres), przy niedoborze witamin B3 i B6 oraz w warunkach stresu azotowego. Do swej aktywności wymaga optymalnej zawartości w diecie kwasu foliowego, witaminy B3 (niacyny), witaminy D, witaminy C, żelaza i miedzi19. Drugi z enzymów (AADC) do swojej aktywności wymaga witaminy B62.
Wygląda na to, że mikrobiota jelitowa ma znaczący wpływ na wielkość biosyntezy 5-HTP. Niezależne badania potwierdziły zdolność niektórych bakterii (Clostridia) do zwiększania zawartości 5-HTP w organizmach zwierząt laboratoryjnych20. Tak samo tyramina i kwas para-aminobenzoesowy (PABA) indukują uwalnianie 5-HTP. Tyramina może powstawać w wyniku aktywności takich bakterii, jak: Streptococcus faecalis, Streptococcus lactis, Micrococcus luteus i Leuconostoc cremoris, które indukują przemianę tyrozyny w tyraminę w jelicie2.
Szlak prowadzący do syntezy indolu
Synteza indolu zależy głównie od beztlenowych bakterii jelitowych mających zdolność przekształcania TRP w indol. Są to różne gatunki Lactobacilli (np. Lactobacillus reuteri), które przekształcają TRP do indolu w warunkach głodu węglowodanów, gdy bioaktywne pochodne indolu są wykorzystywane jako źródło energii21. Metabolity indolowe biorą udział w regulowaniu rozrostu mikrobioty patogennej w jelitach poprzez swoją zdolność do wiązania się z receptorem arylowym (AhR)22, 23. Aktywatorami receptorów arylowych są: związki fenolowe (karbazole) z warzyw krzyżowych oraz inne związki polifenolowe (m.in. kwercetyna, rutyna, daidzeina i inne)24.
Krótkołańcuchowe kwasy tłuszczowe (SCFA)
Są wytwarzane przez ogromną liczbę bakterii „pożytecznych”, czyli komensalnych. Społeczność komensalnych bakterii zapobiega przerostowi bakterii patogennych poprzez kilka strategii, m.in. poprzez syntezę krótkołańcuchowych kwasów tłuszczowych (SCFA). SCFA mają bardzo wszechstronne zastosowanie2, 25:
- Zmieniają metabolizm komórek gospodarza poprzez wpływ na receptory dla SCFA (receptory sprzężone z białkiem G), takie jak GPR41 (FFAR3), GPR43 (FFAR2), Gpr109a (PUMA-G), które są obecne na powierzchni komórek nabłonkowych jelita, adipocytów, enteroendokrynnych komórek L, komórek układu odpornościowego, neuronów.
- Zmieniają warunki środowiskowe w jelicie gospodarza (wpływając na stężenie jonów wodorowych – pH). I tak, pH okrężnicy wynoszące 5,5 stymuluje fermentację do kwasu masłowego, natomiast fermentacja do kwasu octowego jest nasilona przy pH = 6,526.
- Pełnią funkcje troficzne dla kolonocytów i różnych gatunków bakterii jelitowych.
- Mają działanie przeciwzapalne.
- Regulują odpowiedź immunologiczną, zwiększając różnicowanie komórek Treg, co ma kluczowe znaczenie dla utrzymania własnej tolerancji (np. na składniki posiłku, własne antygeny). Biorą udział w tłumieniu alergii, astmy i immunopatologii wywołanej patogenem, zapobieganiu chorobom autoimmunologicznym. Działają na inne komórki układu odpornościowego (np. makrofagi, neutrofile).
- Są modulatorami procesów epigenetycznych jako inhibitory procesu deacetylacji histonów (HDAC), np. obniżają ekspresję kilku genów zjadliwości drobnoustrojów.
- Indukują proces apoptozy (szczególnie kwas masłowy).
- Mają niezwykłe funkcje metaboliczne: korzystnie modulują funkcję tkanki tłuszczowej, zapobiegając otyłości (szczególnie aktywacja receptora GPR43), kontrolują apetyt (receptor GPR41) i homeostazę glukozy (GPR43).
- Regulują funkcję osi mózgowo-jelitowej12. Wykazano, że we krwi kobiet cierpiących na depresję zawartość niektórych SCFA, np. kwasu octowego, znacząco spada (podobna tendencja jest w przypadku kwasu propionowego)27.
- Octan i maślan są również strukturalnie spokrewnione z ciałami ketonowymi, odpowiednio: acetooctanem i β-hydroksymaślanem – oba wykazują obiecujące działanie w terapii zaburzeń neurologicznych28.
SCFA są wytwarzane przez bakterie jelitowe podczas procesu fermentacji włókien roślinnych i niektórych aminokwasów (glutaminy, asparaginy)2. Włókna, takie jak inulina i guma guar, powodują szybki wzrost zawartości SCFA w osoczu w ciągu 6 godzin po spożyciu 20–30 g (w formie suplementu)29, 30. Podobnie działa długoterminowe (od kilku dni do kilku tygodni) spożycie 20–30 g skrobi opornej25. Doskonałym źródłem skrobi opornej jest skrobia kukurydziana o wysokiej zawartości amylozy (HAMS), obecna np. w pieczywie31. Doskonałym źródłem energii dla bakterii mogą być oligosacharydy arabinoksylanowe (AXOS). Ich zawartość w chlebie można podnieść poprzez dodanie ksylanazy przed pieczeniem31.
Gdzie jeszcze znajdziemy cenne oligosacharydy, włókna roślinne służące do syntezy SCFA2?
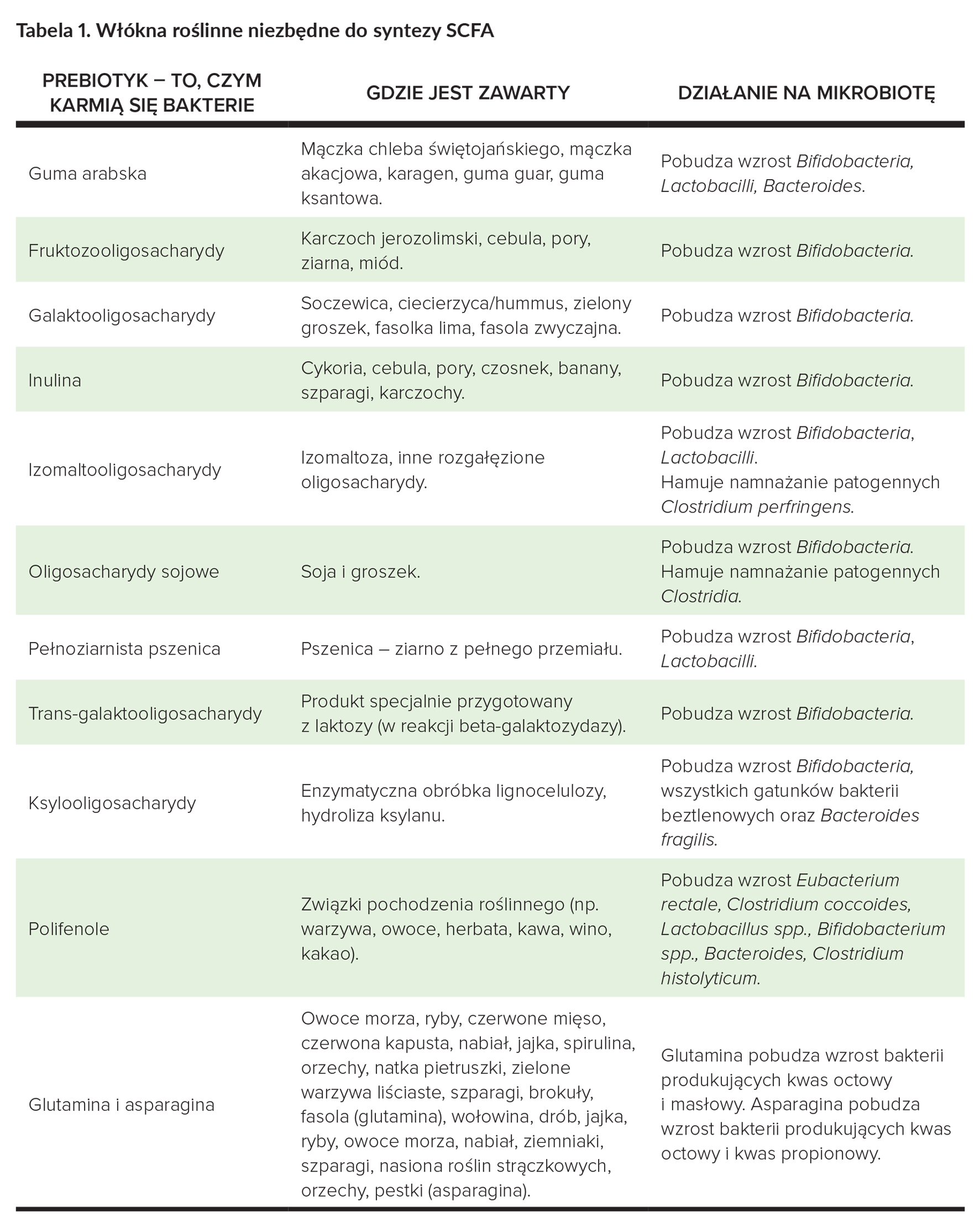
Bakteriami zaangażowanymi głównie w syntezę SCFA są dominujące w okrężnicy: Bacteroides, Roseburia, Fecalibacterium, Bifidobacterium i Enterobacteria, syntezujące octan, propionian i maślan2. Syntezę SCFA można „podkręcić” za pomocą niektórych gatunków bakterii probiotycznych: probiotykami z gatunku Lactobacillus (np. Lactobacillus sakei, Lactobacillus reuteri, Lactobacillus paracasei, Lactobacillus plantarum, Lactobacillus acidophilus, Lactobacillus salivarius) i Bifidobacterium breve 2.
Oś mózg-jelita kształtuje się za młodu, dlatego wśród wielu ważnych czynników bardzo istotna jest dieta matki i dziecka
Wpływ na późniejsze funkcjonowanie osi ma wiele czynników występujących na początku życia – podczas pierwszych 1000 dni życia. Do kluczowych zaliczyć można2 następujące:
- kontakt z bakteriami w czasie ciąży i podczas porodu, np. Serratia znajdowana w smółce jest powiązana z kształtowaniem się odpowiedzi immunologicznej u noworodka32, narażenie na procedury medyczne podczas porodu (antybiotykoterapia, sztuczna wentylacja33);
- to, czy poród odbywa się przed terminem, czy też jest w terminie33, 34;
- choroby autoimmunologiczne matki oraz przyjmowanie antybiotyków przez matkę w czasie ciąży35;
- cukrzyca, narażenie na stres podczas ciąży36;
- masa ciała matki podczas ciąży36,37;
- dieta matki w czasie ciąży (zawartość witaminy D w diecie, zawartość w diecie donorów reszt metylowych, zawartość w diecie wielonienasyconych kwasów tłuszczowych, zanieczyszczenia obecne w żywności)38.
Po urodzeniu kolejnym czynnikiem kształtującym kompozycję mikrobiomu jelitowego dziecka jest dieta matki i dziecka. Dziecko karmione piersią ma stworzone warunki do dynamicznego rozwoju bakterii z przewagą gatunków należących do Bifidobacteria. Niemowlęta karmione piersią mają dwie „mamy”: biologiczną mamę oraz „mikrobiotę odżywiającą się mlekiem” (MOM – Milk-Oriented Microbiota). MOM – to korzystne bakterie zamieszkujące jelita dziecka, które rozwijają się dzięki trawieniu cukrów zawartych w mleku mamy39, 40. Obliczono, że dziecko karmione piersią ma kontakt z 1–10 milionami bakterii znajdujących się w pokarmie, a ich zawartość i jakość podlega dynamicznym zmianom w zależności od okresu laktacji – siara i mleko dojrzałe są najbardziej zróżnicowane pod tym względem41. Ponadto mleko matki zawiera wiele różnych czynników wpływających na rozwój mikrobioty jelitowej dziecka, w tym cząsteczki odpornościowe, takie jak: leukocyty, immunoglobuliny, laktoferyna42 i niestrawne oligosacharydy, które przyczyniają się do wzrostu Bifidobakterii w jelicie grubym dziecka43. Oligosacharydy ludzkiego mleka (HMO) są naturalnym prebiotykiem. Bogactwo HMO w mleku wpływa na różnorodność bakteryjną, utrzymując obfitość szczepów Bifidobacterium longum subsp. infantis w pierwszych miesiącach życia dziecka, oraz zapobiega przyleganiu patogenów do nabłonka jelit44. Mleko kobiece utrzymuje mikrobiotę w stanie charakteryzującym się małą różnorodnością i dominacją Bifidobacterium korzystnego dla zdrowia dziecka. Wprowadzenie żywienia uzupełniającego zwiększa różnorodność mikroorganizmów i wzrost drobnoustrojów charakteryzujących osoby dorosłe należące do rodzin Lachnospiraceae i Ruminococcaceae45.
Wczesne etapy życia dziecka są decydujące w tworzeniu prawidłowej kompozycji mikrobioty jelitowej (ten etap kończy się około 3 roku życia), która z kolei odgrywa istotną rolę w rozwoju dalszych umiejętności poznawczych dziecka, kształtowaniu układu nerwowego, a także odporności na warunki stresowe i podatności na choroby neurodegeneracyjne2.
Mikrobiota osoby dorosłej, czyli jak się żywić, żeby utrzymać mikroorganizmy „przyjazne” dla osi mózgowo-jelitowej w znakomitej kondycji
Wydaje się, że w wieku dorosłym nasz mikrobiom uzyskuje stan „przemijającej stabilności”. Dobrostan mikrobioty jelitowej, rozumiany jako duża liczba i zróżnicowanie gatunków bakterii w jelicie, można łatwo zmienić w brak dobrostanu. Czynnikami, które mają negatywny wpływ na mikroorganizmy, są2:
- ostry/przewlekły stres,
- nieodpowiednia dieta,
- leczenie,
- styl życia (np. narażenie na smog, picie alkoholu, intensywna aktywność fizyczna, długość snu).
Jaka dieta jest odpowiednia? Taka, która może stymulować wytworzenie „śródziemnomorskiego” jelita, czyli dieta przeciwzapalna, w której mikrobiota charakteryzuje się dużą różnorodnością gatunkową (duża liczba bakterii z rodzaju Bifidobacteria, Bacterioides, Prevotella, a mniejsza z rodzaju Firmicutes), dużą zawartością SCFA w stolcu przy jednocześnie niskim stężeniu zonuliny (markera nieszczelnej bariery jelitowej)46.
Do poprawy funkcjonowania mikrobioty i utrzymania sprawnej bariery jelitowej wymagana jest żywność bogata w błonnik, witaminę A, witaminę D, cynk oraz magnez46. Kluczowymi składnikami diety przeciwzapalnej (oprócz włókna niezbędnego do syntezy SCFA – tabela 1) są związki fitochemiczne (polifenole i związki flawonowe) uzyskiwane z owoców, nasion, kory lub liści niektórych roślin. Związki fitochemiczne (stosowane w diecie jako składowe przypraw i ziół) selektywnie odżywiają i stymulują wzrost (lub hamują rozwój) określonych bakterii w okrężnicy, a także wykazują silne właściwości przeciwutleniające. Związki te używane do celów leczniczych zapobiegają chorobom, mają działanie przeciwdrobnoustrojowe, przeciwzapalne, przeciwmutagenne, a także zmniejszają ryzyko raka, chorób serca i cukrzycy47. Spośród 50 produktów spożywczych o najwyższych stężeniach przeciwutleniaczy 4 stanowią przyprawy, 8 – owoce i warzywa, 5 – to owoce jagodowe, 5 – produkty na bazie czekolady, 5 – płatki zbożowe, a 4 – to orzechy lub nasiona. W rankingu na szczycie listy znalazły się jeżyny, orzechy włoskie, truskawki, karczochy, żurawina, parzona kawa, maliny, orzechy pekan, jagody, mielone goździki, sok winogronowy i niesłodzona czekolada48. Najbardziej antyoksydacyjnymi przyprawami są: oregano, imbir, cynamon i kurkuma48.
Trzeba jeszcze dodać, że niektóre przyprawy, takie jak: czarny pieprz, pieprz cayenne, cynamon, imbir, oregano, rozmaryn i kurkuma, mają działanie prebiotyczne, wywołujące pozytywne zmiany w mikrobiocie jelitowej człowieka47. Te przyprawy przyczyniają się do stymulacji wzrostu pożytecznych bakterii (Lactobacilli i Bifidobacteria) w jelicie grubym oraz hamowania rozrostu patogennych bakterii, wywierając działanie podobne do prebiotyków49. Innymi związkami flawonowymi o działaniu prebiotycznym są proantocyjanidyny (PA). To jedne z najbardziej rozpowszechnionych flawonoidów w diecie człowieka, a obecne są w winogronach (w nasionach i skórce), jabłkach, kakao, czerwonym winie, jagodach, żurawinie, czarnej porzeczce, orzechach laskowych, orzechach pekan i pistacjach. Chociaż nie ma wiarygodnych danych na temat ilości polifenoli docierających do okrężnicy u człowieka, badania na zwierzętach pokazują, że 85% antocyjanów z jagód dociera do okrężnicy, a 69% znika z przewodu pokarmowego po 4 godzinach. Jest to czas wystarczający do aktywnego wpływu na mikrobiom i jednocześnie do aktywnego przekształcania związków flawonowych przez bakterie do ich pochodnych, np. kwasu 3-hydroksybenzoesowego (3-HBA) czy kwasu 3-(30-hydroksyfenylo-)propanowego (3-HBB), powstałych z bakteryjnej fermentacji nasion winogron50, 51, 52.
Wśród polifenoli szczególnie korzystnie oddziałujących na mózg należy wymienić właśnie związki uzyskane z fermentacji (bakteryjnej w jelitach) nasion winogron53 oraz jagód. Wykazano, że 30 g liofilizowanych jagód zjadanych codziennie miało pozytywny wpływ na nastrój u dzieci i osób dorosłych54. U osób starszych 12 tygodni stosowania koncentratu jagodowego (30 ml/dzień, zawierającego 387 mg antocyjanidyn) przyniosło zauważalną poprawę funkcji poznawczych55. Pozytywny efekt wywiera także kurkumina (diferuloylmetan) – główny składnik aktywny ostryżu (Curcuma longa). Kurkumina jest w stanie przekroczyć barierę krew-mózg i działać przeciwzapalnie w mózgu. Dlatego kurkumina ma szeroki potencjał terapeutyczny, właściwości przeciwutleniające i przeciwzapalne56.
Cennym związkiem flawonowym jest uzyskany z zielonej herbaty 3-galusan epigallokatechiny (EGCG). Zielona herbata i jej aktywny składnik, czyli EGCG, modulują funkcje komórek odpornościowych i poprawiają stan chorych na stwardnienie rozsiane57. W modelu zwierzęcym (myszy C57BL/6) podanie EGCG w dawce 50 mg/kg masy ciała dziennie odegrało kluczową rolę w tworzeniu i utrzymywaniu struktury mieliny58.
Produkty fermentowane poprawiające funkcjonowanie osi mózgowo-jelitowej
Jogurty
Badania wykazały, że codzienne podawanie 100 g jogurtu probiotycznego zawierającego dwa szczepy: Lactobacillus acidophilus LA5 i Bifidobacterium lactis BB12 (zawartość bakterii m.in. 1 × 107 CFU) spowodowało podobną poprawę nastroju (redukcję intensywności odczuwania lęku, depresji i stresu) jak stosowanie wielogatunkowej kapsułki probiotycznej zawierającej siedem bakterii probiotycznych (Lactobacillus casei, L. acidophilus, L. rhamnosus, L. bulgaricus, Bifidobacterium breve, B. longum, Streptococcus thermophilus + fruktooligosacharyd i laktoza jako substancje nośnikowe). Z drugiej strony, stosowanie w diecie jogurtu kontrolnego zawierającego kultury starterowe Streptococcus thermophilus i Lactobacillus bulgaricus nie przyniosło istotnej poprawy markerów zdrowia psychicznego59. Niskotłuszczowy jogurt jest dobrym wyborem dla poprawy i redukcji przewlekłego stanu zapalnego i ekspozycji na endotoksyny u kobiet po menopauzie. Stosowany przez 9 tygodni w ilości 339 g dziennie zmniejszył biomarkery przewlekłego stanu zapalnego (TNF-α/sTNF-RII oraz LBP/sCD14) we krwi i przyczynił się do poprawy ciśnienia rozkurczowego o 3–6%60.
Kefiry
Tak samo kefir, inny napój probiotyczny składający się z mleka fermentowanego przez kultury grzybów kefirowych i bakterii61, jest zaliczany do żywności funkcjonalnej wspierającej funkcjonowanie mózgu zwierząt62, 63. Kefir podawany gryzoniom zmniejszył u nich objawy depresji64. Podawany kobietom poprawił ich nastrój i jakość życia65. Kefir zawiera wiele gatunków żywych bakterii, w tym: Lactobacillus paracasei ssp. paracasei, Lactobacillus acidophilus, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus plantarum i Lactobacillus kefiranofaciens, Lactobacillus kefiri, Acetobacter aceti i Acetobacter rasens66, 67, a także ponad 23 różne gatunki drożdży, z których większość stanowią Saccharomyces cerevisiae, Saccharomyces unisporus, Candida kefyr i Kluyveromyces marxianus subsp. marxianus68, 69.
Kefiry wodne
Dla osób niepijących mleka i jego przetworów alternatywą może być kefir wodny. Kultury bakterii i grzybów kefiru (ziarna kefirowe) znane są z tego, że fermentują wiele produktów niemlecznych, w tym soki owocowe i warzywne, a nawet zwykłą osłodzoną wodę70, 71. Ziarna kefiru wodnego zawierają różnorodne gatunki drobnoustrojów podobne do tych w ziarnach kefiru mlecznego, w tym: Lactobacillus casei/paracasei, Lactobacillus harbinensis, Lactobacillus hilgardii, Bifidobacterium psychraerophilum/crudilactis, Lactobacillus nagelii, Lactobacillus hilgardii, Leuconostoc mesenteroides, Saccharomyces cerevisiae i Dekkera bruxellensis71, 70. Zawarte w kefirze wodnym kultury bakterii kwasu mlekowego są w stanie wytwarzać egzopolisacharydy z sacharozy, co sprawia, że kefir wodny ma szerokie spektrum działania właściwe dla napoju probiotycznego72.
Kiszonki
Innymi sfermentowanymi produktami spożywczymi, które dostarczają materiału genetycznego żywych drobnoustrojów do organizmu, są kiszonki, np. kiszona kapusta, kiszone ogórki, kimchi, kombucha73. Osoby stosujące sfermentowaną żywność odnoszą wiele korzyści zdrowotnych74, chociaż brakuje badań, które w sposób dogłębny udowodniłyby korzystne działanie żywności sfermentowanej na zdrowie człowieka75. Z drugiej strony, pojawiają się badania wykazujące pozytywny wpływ szczepów bakteryjnych pochodzących z żywności fermentowanej na funkcje bariery jelitowej oraz na działanie potencjalnie przeciwlękowe (szczepy L. helveticus R0052 i B. longum)76. Pewne jest natomiast, że kiszonki są bogatym źródłem witamin z grupy B. Dzieje się tak dlatego, że mikroorganizmy wytwarzają niektóre z nich podczas fermentacji żywności – chodzi o ryboflawinę (B2), niacynę (B3), pirydoksynę (B6) i kwas foliowy. Szacuje się, że mikrobiota pokrywa 37% dziennego zapotrzebowania na kwas foliowy, 31% – na kobalaminę (B12) i 86% – na pirydoksynę (B6)77, czyli witaminy, których często brakuje w grupach osób chorych na depresję76.
Dla wielu osób żywość fermentowana jest bardziej atrakcyjna niż przyjmowanie suplementów probiotycznych. Z punktu widzenia medycyny opartej na dowodach stosowanie żywych kultur bakterii w formie probiotyku (psychobiotyku) przynosi jednak o wiele bardziej wymierne korzyści.
Psychobiotyki – specyficzne probiotyki
Ponad 5 lat temu zespół uczonych z Irlandii wprowadził termin „psychobiotyki” dla określenia nowej klasy preparatów probiotycznych oddziałujących na oś mózgowo-jelitową i wykazujących korzyści zdrowotne u pacjentów leczonych z powodu zaburzeń psychicznych78. Na naszym rynku jednym z najlepiej przebadanych psychobiotyków jest preparat Sanprobi® Stress zawierający szczepy bakterii Lactobacillus helveticus Rosell® 52 oraz Bifidobacterium longum Rosell® 175. Jego korzystne działanie zostało udowodnione w badaniach z udziałem zwierząt i ludzi, co zostało opisane szczegółowo w artykule dr Skoniecznej-Żydeckiej78.
Dość powiedzieć, że ta mieszanina szczepów w ciągu 3 tygodni (w dawce 1 kapsułka dziennie) przyczyniła się do redukcji objawów somatycznych przewodu pokarmowego u osób narażonych na stres (redukcja: bólu brzucha, uczucia przelewania się, zaparć/biegunek) 79.
W innych badaniach Sanprobi® Stress podawano grupie 55 ochotników (30 dni, 1 kapsułka dziennie). Probiotyk istotnie poprawił objawy psychologiczne związane ze stresem – istotnie obniżył intensywność doświadczanego lęku i depresji, redukując stężenie kortyzolu we krwi80.

